2021年8月25日,四川大学华西药学院“血管疾病和肺癌分子药理学”贾涛课题组和法国国家科学院高级生命科学研究所 (CNRS, IAB) “RNA剪切和药物靶向治疗” Beatrice Eymin 课题组合作在BMC Biology 发表了题为 “FGF-2 promotes angiogenesis through a SRSF1/SRSF3/SRPK1-dependent axis that controls VEGFR1 splicing in endothelial cells” 的研究论文。该研究首次揭示了碱性成纤维生长因子(FGF2)在转录后水平(RNA)上的基因表达调控,促血管生成(angiogenesis)的分子机制。
研究表明FGF2通过激活原代血管内皮细胞的剪切因子SRSF1、SRSF3以及调控剪切因子蛋白的激酶信号,诱导血管内皮生长因子受体1(VEGFR1)的mRNA 前体通过选择性保留最后一个外显子12(ALE)的方式产生可溶性sVEGFR1-ex12(VEGFR1受体没有跨膜和胞内结构域);同时在恶性肿瘤肺鳞状癌病人的肿瘤组织中,发现可溶性sVEGFR1-ex12分子与FGF2、FGFR1信号分子转录水平表达具有高正相关性,并确认sVEGFR1-ex12高表达是肺鳞癌病人预后差的分子标记物(图1)。
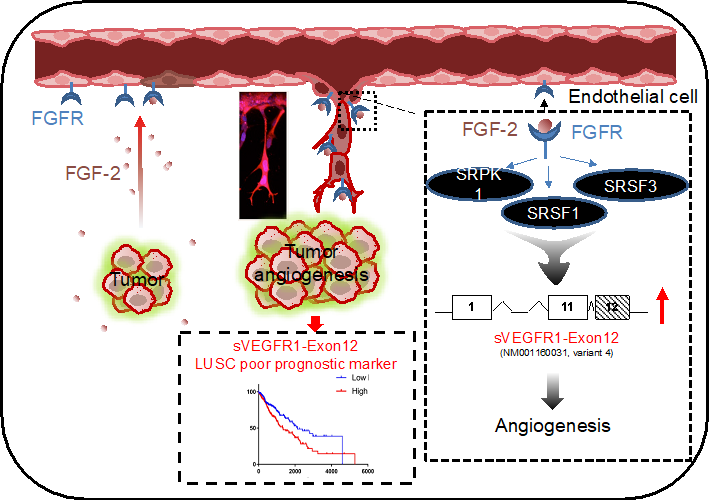
图1: FGF2调控内皮细胞血管生长因子受体1(VEGFR1)的mRNA可变剪接, 促血管生成以及肺鳞癌肿瘤发生。
碱性成纤维生长因子FGF2是肝素结合生长因子FGF家族最具代表性的活性分子(Bikfalvi et al., 1997; Presta et al., 2005) 。大量体内以及体外的实验证据都显示FGF2无论是在生理还是在病理语境下,在诱导血管生成过程中都起到非常重要的作用 (Tao Jia et al., 2020) 。然而,FGF2诱导血管生成的机制,特别是转录后调控的机制以及在这个层面上寻找靶向FGF2治疗的分子标记物的探究都几乎是空白。
Pre-mRNA 选择性剪接在调节细胞和组织稳态中起着关键作用。目前公认的观点,超过 90% 的人类蛋白质编码基因通过选择性剪切产生具有不同结构和功能特性的同种型蛋白质(Pan et al., 2008)。这个过程受到剪接因子的精准控制,包括属于 SR 蛋白(富含丝氨酸/苏氨酸蛋白)家族的 SRSF,它们本身受丝氨酸/苏氨酸激酶(如 SRPK1)的调节。我们之前证明了一些 SR 蛋白,比如SRSF2,在调控肺癌细胞的肿瘤血管生成、细胞凋亡、细胞增殖或对化疗反应中的作用,并证明它们在肺癌患者中出现了表达失调(Merdzhanova et al., 2008; Merdzhanova et al., 2010; Edmond et al., 2010; Edmond et al., 2011; Gout et al., 2012; Edmond et al., 2013; Pesson et al., 2014)。我们进一步证明了它们在肺癌细胞抗血管生成疗法 “逃逸期间” 调节 VEGF-A 或 VEGFR1 选择性剪接中的作用(Abou-Faycal et al., 2018; Abou-Faycal et al., 2019) 。然而目前,不论是从分子机制层面,SR蛋白以及对应上游的信号分子如何行使原代血管内皮细胞的生物学功能;还是从血管靶向治疗层面, “血管发生语境下” 激活内皮细胞SR蛋白调控的下游关键信号结点(潜在的治疗靶点),我们都知之甚少!解析生理和肿瘤病理血管生成语境下,SR蛋白作用的分子机制及其寻找抗肿瘤治疗对应的分子标记物对于理性设计靶向 “肿肿瘤血管生成新疗法” 和新的药物联用” (比如免疫联合治疗)有重要的意义。
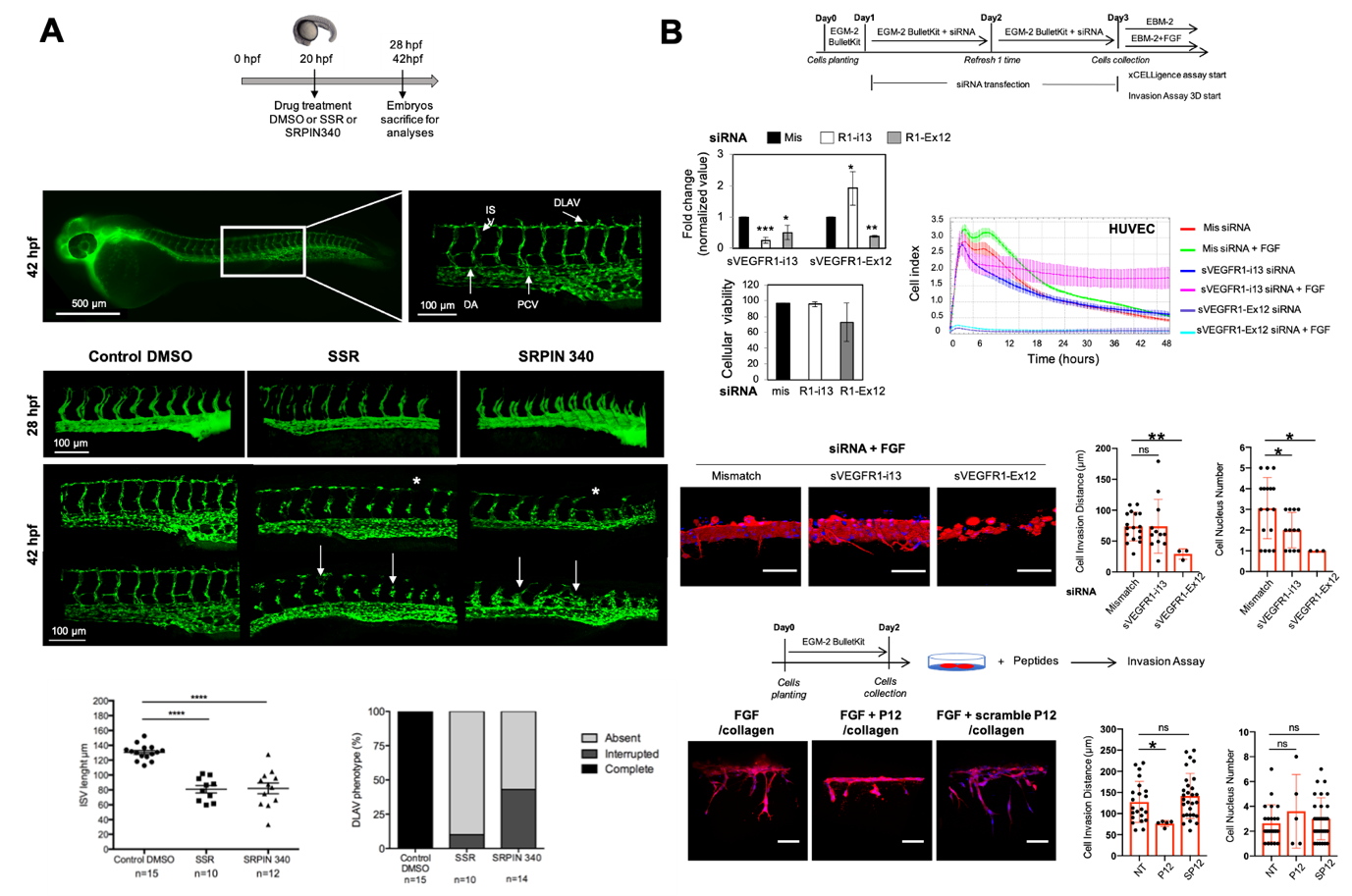
图2: A图,丝氨酸/苏氨酸激酶SRPK1抑制剂扰乱斑马鱼胚胎的血管发生;B图,sVEGFR1-ex12调控血管内皮细胞增殖、存活、侵袭和“发芽”。
此项研究通过结合原代血管内皮细胞二维、三维培养,小鼠海绵体血管生成和斑马鱼血管生成模型,以及体外和体内细胞和分子生物学功能验证(图2),发现FGF2通过激活SRSF1/SRSF3/SRPK1 信号传导诱导VEGFR1 mRNA 可变剪接促sVEGFR1-ex12表达,进而促血管内皮细胞增殖、存活、侵袭和“发芽”的作用机制;同时,提出FGFR络氨酸激酶抑制剂和RNA剪接抑制剂(如SPHINX31)药物联用,靶向FGF2/SRSF1/SRSF3/SRPK1互作的“信号网络”可能成为抗恶性肿瘤,比如肺非小细胞癌更优的治疗方式。该研究同时得到ARC癌症研究基金会国际合作项目(ARC_PGA1_20160203791)和INCA国家癌症研究所 (INCA-PLBIO 2016-155) 的资助。
文章链接:https://bmcbiol.biomedcentral.com/articles/10.1186/s12915-021-01103-3